Üreticiler MDR gerekliliklerini karşılamak ve ürün uygunluklarını göstermek için aşağıda listelenen raporları belirli periyotlarda hazırlamalı ve güncel olmaları sağlamalıdır.
- Klinik Veri Değerlendirme Raporu (CER - Clinical Evaluation Report)
- Piyasaya arz sonrası Klinik Takip Raporu (PMCF - Evaluation Report)
- Piyasaya arz sonrası Gözerim Raporu (PMSR - Post-Market Surveillance Report)
- Periyodik Güvenlilik Güncelleme Raporu (PSUR - Periodic Safety Update Report)
- Güvenlilik ve Klinik Performans Özeti (SSCP - Summary of Safety and Clinical Performance)
Klinik Veri Değerlendirme Raporu (CER - Clinical Evaluation Report):
MDR’ın (2017/745), 61 (11) maddesine göre Klinik değerlendirme ve dokümantasyonu, ilgili cihazın yaşam döngüsü boyunca, XIV. Ekin B Kısmı uyarınca imalatçının PMCF planının ve 84. Ekte atıfta bulunulan piyasaya arz sonrası gözetim planının uygulanmasından elde edilen klinik verilerle söz konusu cihazın yaşam döngüsü boyunca güncellenir.
Tüm ürün sınıfları (Sınıf I, IIa, IIb ve III) için bizlerden beklenen Klinik Verimizi değerlendirerek rapor haline getirmememiz ve verimizi güncel tutmamızdır. Klinik Veri Değerlendirme Raporu (CER), tüm ürün sınıfları için hazırlanması gereken ve güncelleme sıklığının ürünün riskine ve yapılandırılma seviyesine göre değişeceği bir rapordur.
Tavsiyemiz güncelleme sıklığının en fazla 2 yıl olmasıdır.
Piyasaya arz sonrası Klinik Takip Raporu (PMCF - Evaluation Report):
MDR Ek XIV Kısım B (7) uyarınca İmalatçı, PMCF’nin bulgularını analiz eder ve sonuçları, klinik değerlendirme raporunun ve teknik dokümantasyonun bir bölümü olan PMCF değerlendirme raporunda belgelendirir.
Bu raporlama türünün Klinik verinin hayatımızın ayrılmaz bir parçası olduğunu bize sıklıkla hatırlatacağını söylemek isteriz. Piyasaya arz sonrası Klinik Takip (PMCF) Raporu tüm ürün sınıfları (Sınıf I, IIa, IIb ve III) için hazırlanır. Gerekli olmadığı haller içinse bir gerekçelendirme yapılmalıdır.
Piyasaya arz sonrası Gözerim Raporu (PMSR - Post-Market Surveillance Report):
MDR Madde 85 uyarınca Sınıf I cihazların imalatçıları, yapılan her önleyici ve düzeltici faaliyetin gerekçesi ve açıklaması ile birlikte 84. maddede atıfta bulunulan piyasaya arz sonrası gözetim planının bir sonucu olarak toplanan piyasaya arz sonrası gözetim verilerinin analiz sonuçlarını ve bu sonuçlara dayanan çıktıları özetleyen bir piyasaya arz sonrası gözetim raporu hazırlar. Bu rapor, gerekli olduğunda güncellenir ve talebi üzerine yetkili otoriteye sağlanır.
Sınıf IIa, sınıf IIb, sınıf III cihazlar için Piyasaya arz sonrası Gözetim Raporu (PMSR) gerekmemektedir. Bu risk sınıflarına ait ürünler için sonuçlar Periyodik Güvenlilik Güncelleme Raporu’nda (PSUR) sunulmaktadır.
Periyodik Güvenlilik Güncelleme Raporu (PSUR - Periodic Safety Update Report):
MDR Madde 85 uyarınca; sınıf IIa, sınıf IIb ve sınıf III cihazların imalatçıları, her bir cihaz ve ilgili olduğu yerde her bir cihaz kategorisi veya grubu için, yapılan her önleyici ve düzeltici faaliyetin gerekçesi ve açıklaması ile birlikte 84. maddede atıfta bulunulan piyasaya arz sonrası gözetim planının bir sonucu olarak toplanan piyasaya arz sonrası gözetim verilerinin analiz sonuçlarını ve bu sonuçlara dayanan çıktıları özetleyen bir periyodik güvenlilik güncelleme raporu (“PSUR”) hazırlar.
PSUR raporlarının ürün sınıflarına göre güncellenme periyotları ve rapor yayın metodu aşağıdaki tabloda verilmiştir.
| Ürün Sınıfı | Güncelleme Periyodu | Üretici Rapor Yayın Metodu |
| Sınıf IIa | Gerekli olduğunda ve asgari her iki yılda bir | Uygunluk değerlendirmesine dahil olan onaylanmış kuruluşa ve talebi üzerine yetkili otoritelere PSURlar erişilebilir kılınır. |
| Sınıf IIb | Asgari yıllık olarak | Uygunluk değerlendirmesine dahil olan onaylanmış kuruluşa ve talebi üzerine yetkili otoritelere PSUR’lar erişilebilir kılınır. |
| Sınıf III / İmplante edilebilir Tıbbi Cihazlar | Asgari yıllık olarak | Uygunluk değerlendirmesine dahil olan onaylanmış kuruluşa MDR 92. maddede atıfta bulunulan elektronik sistem vasıtasıyla PSURları sunar. Onaylanmış kuruluş, raporu inceler ve yapılan her faaliyetin ayrıntılarıyla birlikte kendi değerlendirmesini de bu elektronik sisteme ekler. Bu tür PSURlar ve onaylanmış kuruluş değerlendirmeleri, bu elektronik sistem vasıtasıyla yetkili otoritelere erişilebilir kılınır. |
Güvenlilik ve Klinik Performans Özeti (SSCP - Summary of Safety and Clinical Performance):
MDR Madde 32 uyarınca Ismarlama üretilen veya araştırma amaçlı cihazlar hariç olmak üzere; implante edilebilir cihazlar ve sınıf III cihazlar için imalatçı, bir Güvenlilik ve Klinik Performans Özeti hazırlar.
Güvenlilik ve Klinik Performans Özeti, hedeflenen kullanıcı ve ilgiliyse hasta için anlaşılır bir şekilde yazılır ve Eudamed yoluyla kamuya açık olur.
Güvenlilik ve klinik performans özetinin taslağı, 52.madde uyarınca uygunluk değerlendirmesine dahil olan onaylanmış kuruluşa sunulacak dokümantasyonun bir bölümüdür ve bu kuruluş tarafından geçerli kılınır. Onaylanmış kuruluş, özeti geçerli kılmasından sonra Eudamed’e yükler. İmalatçı, özetin bulunduğu yeri etiket veya kullanım kılavuzu üzerinde belirtir.
Güvenlilik ve Klinik Performans Özeti (SSCP) tıbbi cihazların riskleri ve faydaları hakkında hem sağlık profesyonelleri hem de hastalar için doğru bir anlayış oluşturacak şekilde tasarlanmalıdır. Güvenlilik ve Klinik Performans Özeti (SSCP) EUDAMED’de güncel tutulmalı, PMCF değerlendirme raporu ve Periyodik Güvenlilik Güncelleme Raporu (PSUR) en az yılda bir kez güncellendiğinde, klinik ve/veya güvenlik bilgilerinin doğru ve eksiksiz olduğunu güvence altına almak için Güvenlilik ve Klinik Performans Özeti (SSCP) gözden geçirilmeli ve gerekirse güncellenmelidir.
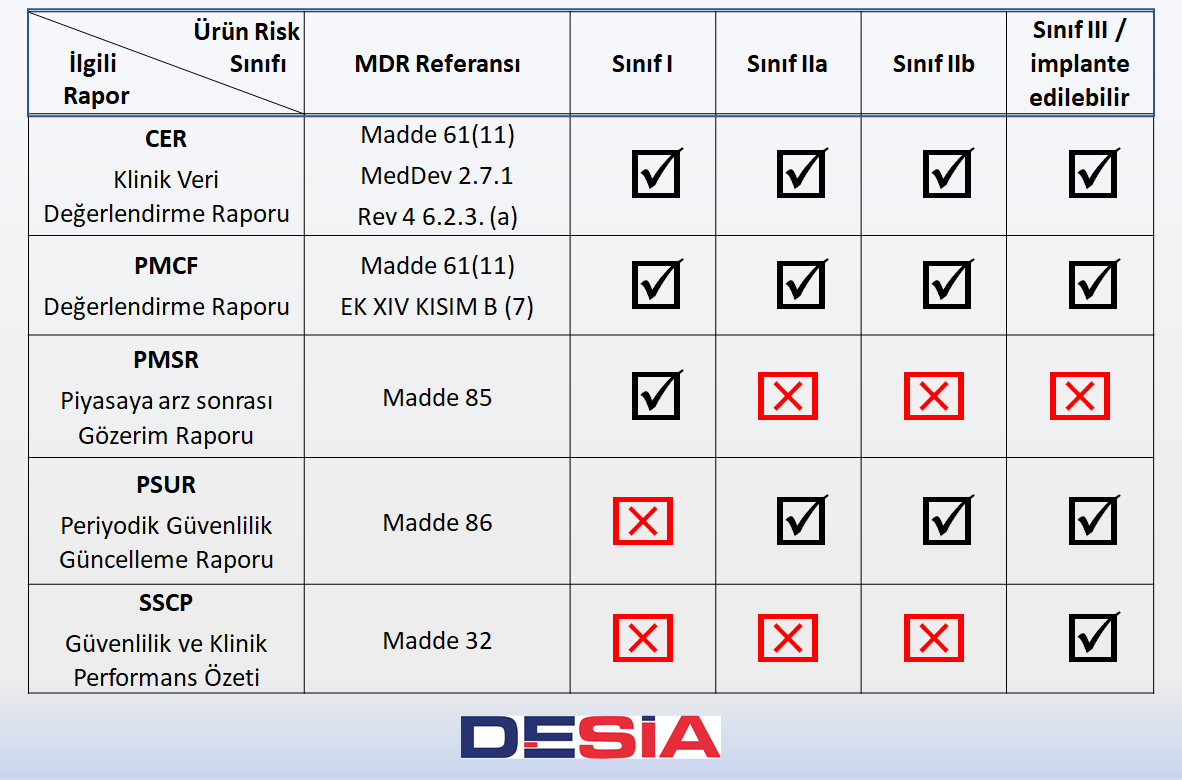
Raporların hangi sınıf ürün için hazırlanması gerektiği ve ilgili MDR maddeleri özet Tablosu
Bildirim gerektiren faaliyetlerle ilgili her risk sınıfı için ilgili tabloya giderek görebileceğiniz bilgi broşürünü indirmek için tıklayınız.





